アルツハイマー病発症機構におけるアミロイド蓄積およびAβ代謝(産生・分解)制御メカニズムの解明
超高齢社会に突入した日本では、認知症患者数は増加の一途をたどり、特に認知症の60%前後を占めるとされるアルツハイマー病の予防・治療法の確立は、急務となっている。我々のチームでは、アルツハイマー病をはじめとする神経変性疾患の病態解明を行い、分子メカニズムに介入する形で予防・治療法解明のための研究を行っている。
(1)アルツハイマー病の発症には、アミロイドβ蛋白(Aβ)の脳内蓄積が深くかかわっていると考えられている。我々は、世界に先駆けてAβ42は強い毒性を発揮するが、Aβ40は神経保護作用を持つことを見出した。すなわち、(i) Aβ42は強い凝集性を持つため神経毒性を発揮するが、単体で存在しうるAβ40は遷移金属をキレートして活性酸素の発生を抑制し、活性酸素による神経細胞死を抑制する。(ii) 単体Aβ40はAβ42と結合することにより、Aβ42のβ-sheet形成を阻害し、Aβ42の重合体形成・線維化を抑制する。その結果、単体Aβ40には、Aβ42のもつ神経毒性を抑制する作用があることを明らかにした。これらの発見は、家族アルツハイマー病患者の血清や脳脊髄液で発見されているAβ42/Aβ40比の上昇現象に理論的根拠を提供することになった。
さらに、我々は、毒性の強いAβ42からアミノ酸2つ切り出して神経保護作用を持つAβ40に変換する(Aβ変換)酵素をアンギオテンシン変換酵素(ACE)であることを特定した。ACEは、血圧制御の中心分子であり、降圧剤の分子標的になっている。この発見は、高血圧症がアルツハイマー病の発症と深く関連していること示唆した。興味深いことに、我々は、家族性アルツハイマー病の原因遺伝子、プレセニリンは、Aβ産生だけではなく、ACEの活性制御にも深く関わっていることを発見した。Aβ産生に関わるγセクレターゼの中心分子であるプレセニリンが孤発性アルツハイマー病の発症機構(Aβ変換/分解)にも関与することが明らかとなり、現在、家族性と孤発性アルツハイマー病の共通発症機序の解明に向けて研究を行っている。
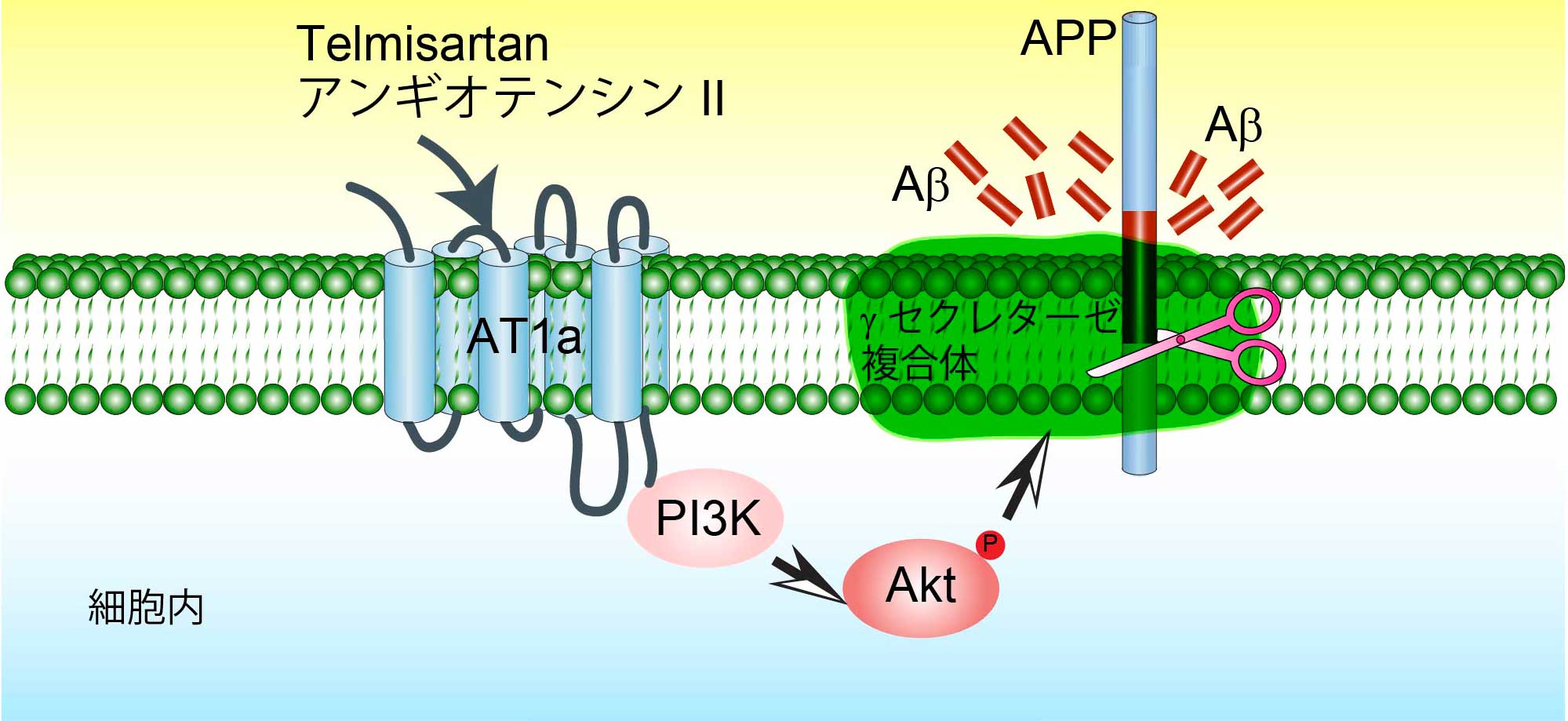
アンギオテンシン受容体およびその阻害薬がAβの賛成を制御する
(2)アルツハイマー病の病理特徴は脳内のアミロイド沈着を主体とするが、レビー小体型認知症とパーキンソン病の原因分子であるα-synuclein、前頭側頭型認知症と筋萎縮性側索硬化症の原因分子であるTDP-43の蓄積も同時に存在する症例が多い。我々は、α-synucleinの発現や分泌を制御する分子、およびTDP-43の核からの喪失および細胞質での蓄積を制御する分子の同定を進めており、新たにα-synucleinおよびTDP-43の異常蓄積を制御する分子を発見した。現在、これらの制御分子の欠損細胞およびノックアウトマウスを用い、α-synucleinおよびTDP-43の異常蓄積機構の解明およびこれらの原因分子の蓄積を抑制する方法の開発を目指している。
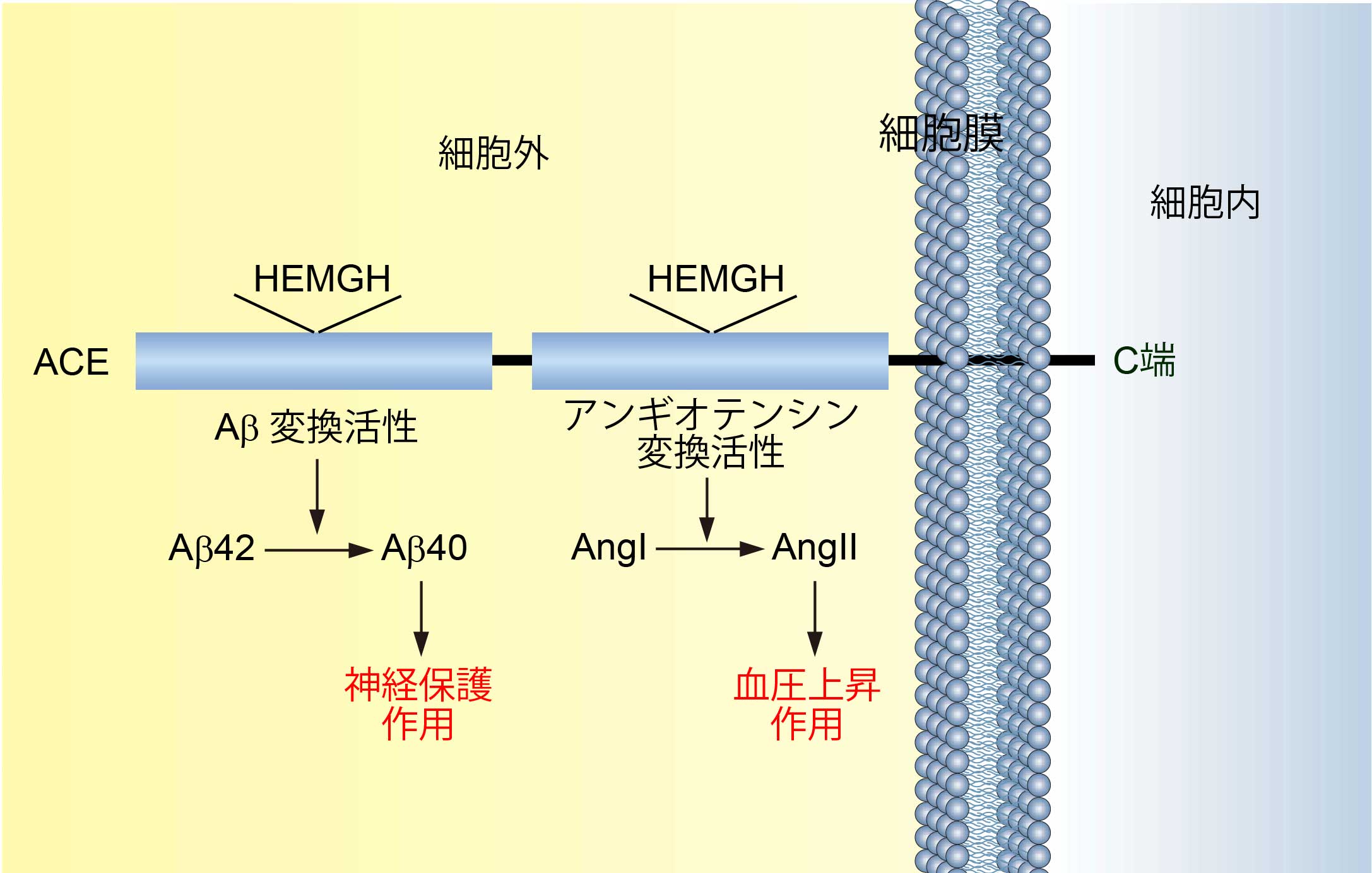
ACEの血圧制御機能とAβ変換機能は異なる活性ドメインに存在する