研究プロジェクト
- HOME
- 研究プロジェクト
- クロマチン制御因子の小脳発生と髄芽腫形成における役割の解析
- 脳腫瘍特異的な融合遺伝子の発がん機能の解析
- 脳腫瘍と脳内微小環境の新研究
- アルツハイマー病発症機構におけるアミロイド蓄積およびAβ代謝(産生・分解)制御メカニズムの解明
クロマチン制御因子の小脳発生と髄芽腫形成における役割の解析
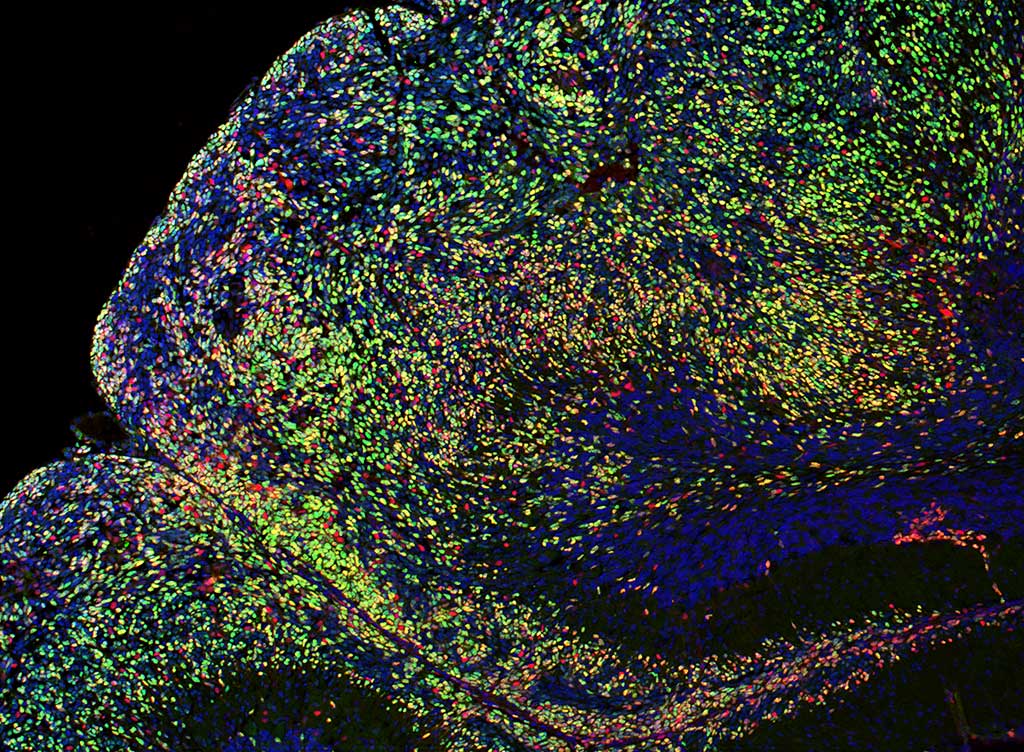
近年、次世代シーケンス技術の発展によって、小児脳腫瘍のひとつである髄芽腫(ずいがしゅ)の分子レベルでの理解が大きく進んできました。特に、髄芽腫ではクロマチン制御因子(=DNAの折りたたみ構造を調節するタンパク質)の変異がよく見られ、これによりエピゲノム(遺伝子の使われ方)が変化していることがわかっています。
しかし、こうした変異が実際にどのように腫瘍の発生や進展に関わっているのか、その仕組みはまだ十分に解明されていません。
そこで本研究では、マウスの遺伝学的手法やCRISPRなどのゲノム編集技術を用いて、まずはクロマチン制御因子が正常な小脳の発生においてどのような役割を果たしているのかを明らかにします。さらに、それらの因子に変異が入ったときにどのような変化が起きて腫瘍が形成されるのかを解析することで、がん発生の新しいメカニズムの理解を目指しています。
このような研究は、「がんの設計図」だけでなく「がんの設計図の読み方(エピゲノム)」に注目するという、新しい視点からのアプローチであり、将来的にはがんの分子特性に応じた治療法の開発にもつながると期待されています。
参考原著論文: Zuckermann et al. Nat Commun. 2015; Feng et al. Nat Commun. 2017; Kutcher et al. Genes Dev. 2020; Shiraishi et al. Dev Cell 2024; Wang et al. Cell Rep 2025
脳腫瘍特異的な融合遺伝子の発がん機能の解析
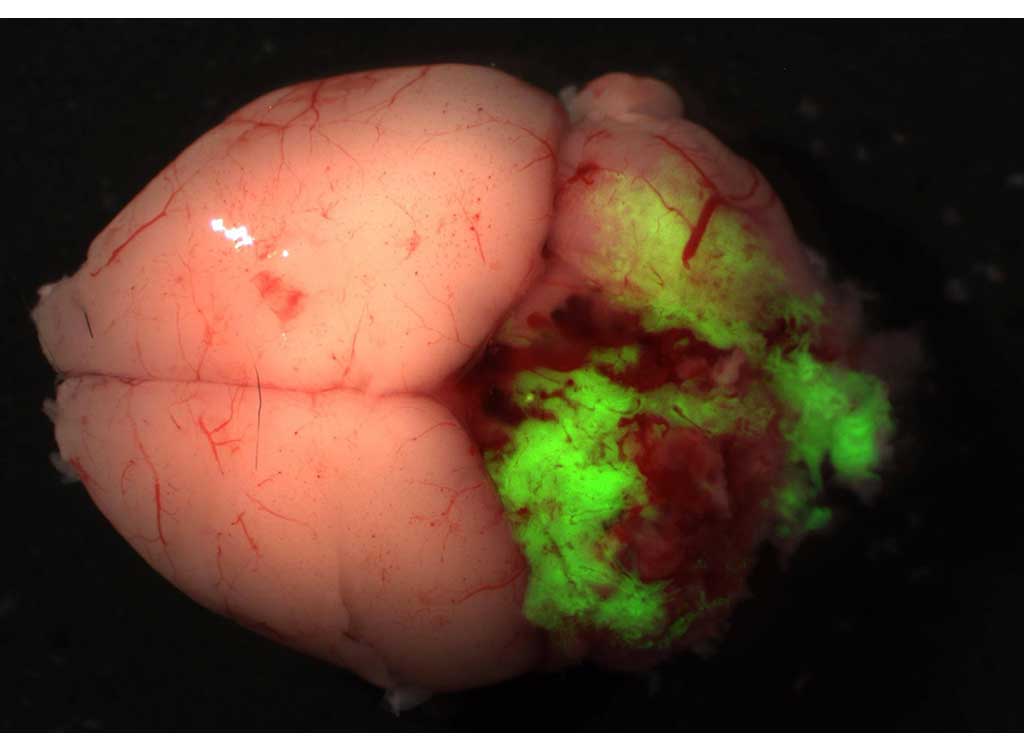
がん細胞では、ときに本来は別々に存在している2つの遺伝子が、ゲノムの異常によってつながり、融合遺伝子と呼ばれる新しい遺伝子がつくられることがあります。
この融合遺伝子は正常な細胞では見られず、がんに特異的な性質を持ち、がんの発生や進展を引き起こす強力なドライバーになることが知られています。
特に小児脳腫瘍では、このような融合遺伝子が重要な役割を果たすことが近年注目されており、2016年に米国で発表されたBlue Ribbon Panelでも、融合遺伝子の研究は小児がんの理解における最優先課題の一つとされました。
私たちの研究では、小児脳腫瘍に特異的に発現する融合遺伝子に注目し、それが腫瘍形成にどのように関与しているのか、またどのようながん特有のシグナル伝達経路を引き起こしているのかを、生体内モデルを用いて明らかにしています。
さらに私たちの成果は、世界保健機関(WHO)による脳腫瘍の最新の分子分類(2021年改訂)にも反映されており、特定の融合遺伝子の存在が、上衣腫のサブグループを定義する上での新たな指標となることを示しました。これは、腫瘍の診断・分類・治療方針の決定において非常に重要な意味を持ちます。
このように、脳腫瘍のさまざまな融合遺伝子の分子機構を理解することで、がんの本質的な性質に迫り、精密医療(Precision Medicine)へとつながる新たな治療戦略の開発を目指しています。
参考原著論文: Pajtler et al. Nat Commun. 2019; Zheng et al. Cancer Discov. 2021
脳腫瘍と脳内微小環境の新研究
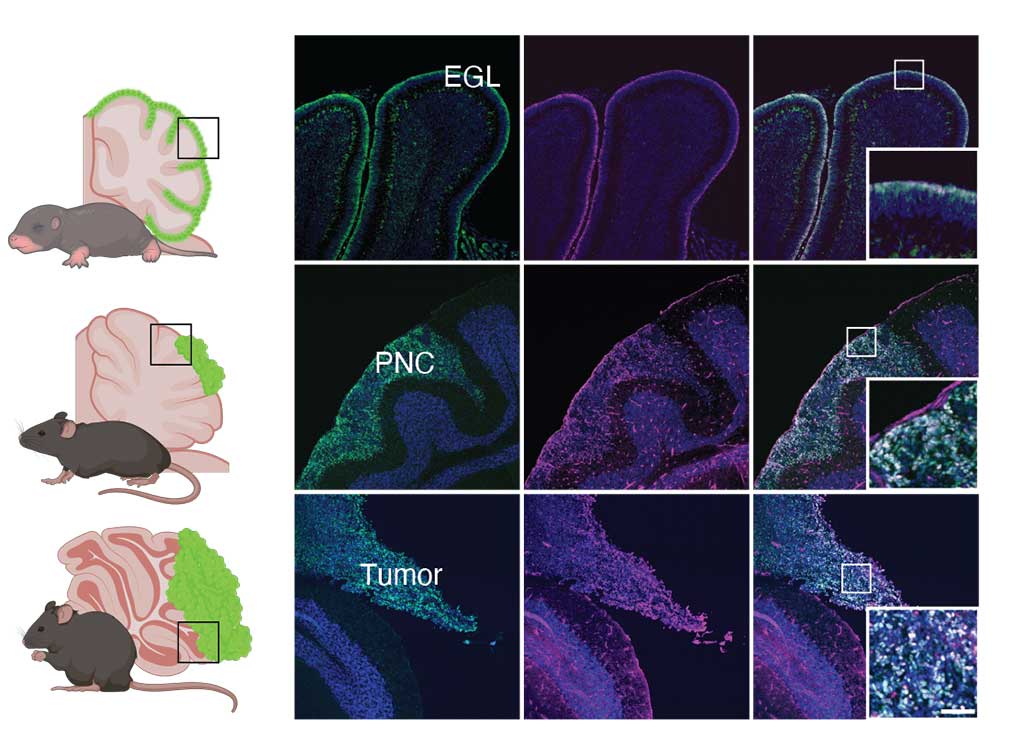
細胞を巻き込みながら、自分にとって有利な環境を作り出すという、非常に巧妙な性質を持っています。
そしてこの性質は、脳腫瘍でも例外ではありません。最近の研究では、脳腫瘍が周囲の神経細胞やグリア細胞と複雑に関わり合いながら、「がんにとって居心地の良い環境」=脳特有の微小環境ネットワークを構築していることが明らかになってきました。
こうしたネットワークが、がんの進展や悪性化を後押ししていると考えられています。しかし、その仕組みを理解するためには、生体内に近い状態でがんがどのように広がっていくのかを観察することが重要です。
私たちの研究室では、これまでに独自に開発してきた小児脳腫瘍モデルを活用し、がんと脳細胞との相互作用の仕組みを詳しく調べています。さらに現在は、
-
東京科学大学の上阪直史教授(神経回路解析)
-
フランス・キュリー研究所のOlivier Ayrault博士(小児脳腫瘍の分子生物学)
との国際共同研究を通じて、
「ヒトの腫瘍サンプルを使ったオミクス解析」と
「マウスを用いた腫瘍モデル」、
そして「神経科学の知見」を組み合わせた、新しい学際的な研究分野を切り開いています。
このような研究は、がんを“脳の中で生きている生き物”としてとらえ直すことで、これまでにない視点から新しい治療戦略を見出すことにつながると期待されています。
参考原著論文: Forget et al. Cancer Cell 2018
「鄒グループ」
アルツハイマー病発症機構におけるアミロイド蓄積およびAβ代謝(産生・分解)制御メカニズムの解明
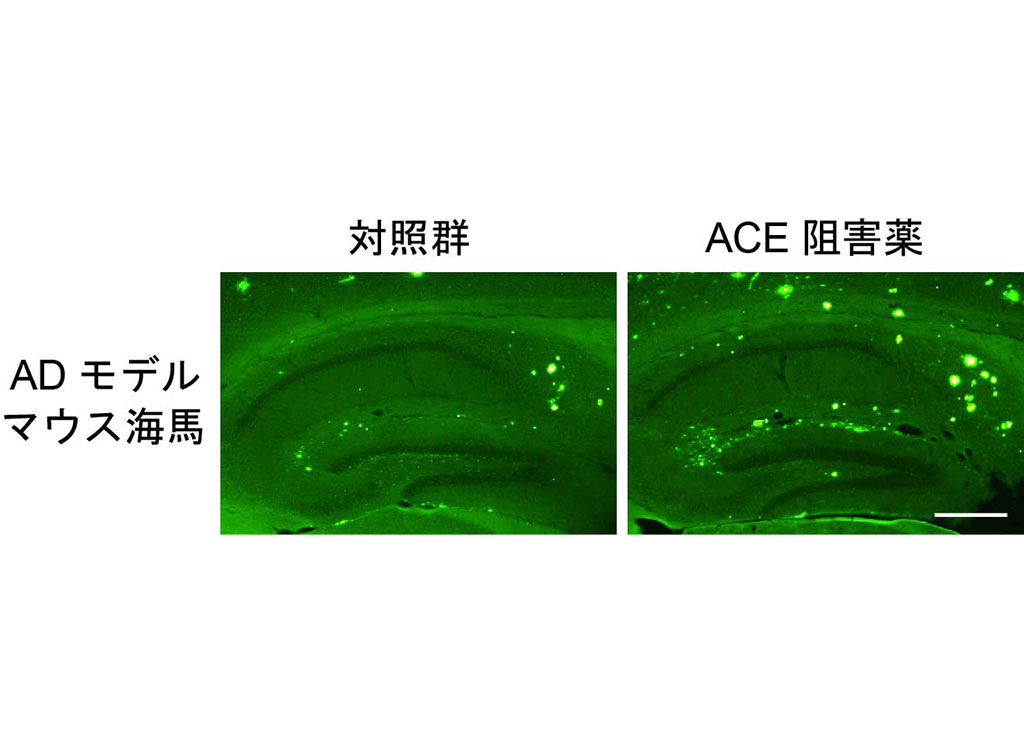
超高齢社会に突入した日本では、認知症患者数は増加の一途をたどり、特に認知症の60%前後を占めるとされるアルツハイマー病の予防・治療法の確立は、急務です。我々のチームでは、アルツハイマー病をはじめとする神経変性疾患の病態解明を行い、分子メカニズムに介入する形で予防・治療法解明のための研究を行っています。
(1)アルツハイマー病の発症には、アミロイドβ蛋白(Aβ)の脳内蓄積が深くかかわっていると考えられています。我々は、世界に先駆けてAβ42は強い毒性を発揮するが、Aβ40は神経保護作用を持つことを見出しました。すなわち、(i) Aβ42は強い凝集性を持つため神経毒性を発揮するが、単体で存在しうるAβ40は遷移金属をキレートして活性酸素の発生を抑制し、活性酸素による神経細胞死を抑制し、(ii) 単体Aβ40はAβ42と結合することにより、Aβ42のβ-sheet形成を阻害し、Aβ42の重合体形成・線維化を抑制します。その結果、単体Aβ40には、Aβ42のもつ神経毒性を抑制する作用があることを明らかになりました。